Segue abaixo algumas questões do ENEM da disciplina de Química que estaremos discutindo e resolvendo com os alunos em sala de aula.
ENEM – 1998
Seguem abaixo alguns trechos de uma matéria da revista “Superinteressante”, que descreve hábitos
de um morador de Barcelona (Espanha), relacionando-os com o consumo de energia e efeitos sobre o
ambiente.
I. “Apenas no banho matinal, por exemplo, um cidadão utiliza cerca de 50 litros de água, que depois
terá que ser tratada. Além disso, a água é aquecida consumindo 1,5 quilowatt-hora (cerca de 1,3
milhões de calorias), e para gerar essa energia foi preciso perturbar o ambiente de alguma
maneira....”
II. “Na hora de ir para o trabalho, o percurso médio dos moradores de Barcelona mostra que o carro
libera 90 gramas do venenoso monóxido de carbono e 25 gramas de óxidos de nitrogênio ... Ao
mesmo tempo, o carro consome combustível equivalente a 8,9 kwh.”
III. “Na hora de recolher o lixo doméstico... quase 1 kg por dia. Em cada quilo há aproximadamente
240 gramas de papel, papelão e embalagens; 80 gramas de plástico; 55 gramas de metal; 40
gramas de material biodegradável e 80 gramas de vidro.”
01) No trecho I, a matéria faz referência ao tratamento necessário à água resultante de um banho. As
afirmações abaixo dizem respeito a tratamentos e destinos dessa água. Entre elas, a mais plausível é a
de que a água:
a) passa por peneiração, cloração, floculação, filtração e pós-cloração, e é canalizada para os rios.
b) passa por cloração e destilação, sendo devolvida aos consumidores em condições adequadas para
ser ingerida.
c) é fervida e clorada em reservatórios, onde fica armazenada por algum tempo antes de retornar aos
consumidores.
d) passa por decantação, filtração, cloração e, em alguns casos, por fluoretação, retornando aos
consumidores.
e) não pode ser tratada devido à presença do sabão, por isso é canalizada e despejada em rios.
02) Com referência ao trecho II, pode-se afirmar que:
a) Um automóvel produz monóxido de carbono pelo fato de que a queima dos combustíveis utilizados
não é completa.
b) Pode-se concluir que o automóvel em questão não utiliza o álcool como combustível.
c) A produção de óxido de nitrogênio contribui para a chuva ácida.
d) O texto está equivocado, pois os óxidos de nitrogênio lançados na atmosfera não têm qualquer
relação com o automóvel.
e) Caso o automóvel fosse elétrico, não poluiria o ambiente com monóxido de carbono, mas lançaria
ao ar radiações eletromagnéticas prejudiciais à saúde.
03) Um dos danos ao meio ambiente diz respeito à corrosão de certos materiais. Considere as seguintes
obras:
I. Monumento Itamarati - Brasília (mármore).
II. Esculturas do Aleijadinho - MG (pedra sabão contém carbonato de cálcio).
III. Grades de ferro ou alumínio de edifícios.
A ação da chuva ácida pode acontecer em:
a) I, apenas.
b) I e II, apenas.
c) I e III, apenas.
d) II e III, apenas.
e) I, II e III.
04) Com relação aos efeitos sobre o ecossistema, pode-se afirmar que:
I. As chuvas ácidas poderiam causar a diminuição do pH da água de um lago, o que acarretaria a
morte de algumas espécies, rompendo a cadeia alimentar.
II. As chuvas ácidas poderiam provocar acidificação do solo, o que prejudicaria o crescimento de
certos vegetais.
III. As chuvas ácidas causam danos se apresentarem valor de pH maior que o da água destilada.
Dessas afirmativas está(ão) correta(s):
a) I, apenas.
b) III, apenas.
c) I e II, apenas.
d) II e III, apenas.
e) I e III, apenas.
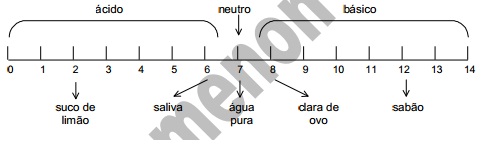
O pH informa a acidez ou a basicidade de uma solução. A escala abaixo apresenta a natureza e o pH
de algumas soluções e da água pura, a 25°C.
Uma solução desconhecida estava sendo testada no laboratório por um grupo de alunos. Esses
alunos decidiram que deveriam medir o pH dessa solução como um dos parâmetros escolhidos na
identificação da solução. Os resultados obtidos estão na tabela abaixo.
Aluno Valor de pH
Carlos 4,5
Gustavo 5,5
Simone 5,0
Valéria 6,0
Paulo 4,5
Wagner 5,0
Renata 5,0
Rodrigo 5,5
Augusta 5,0
Eliane 5,5
05) Da solução testada pelos alunos, o professor retirou 100mL e adicionou água até completar 200mL de
solução diluída. O próximo grupo de alunos a medir o pH deverá encontrar para o mesmo:
a) valores inferiores a 1,0.
b) os mesmos valores.
c) valores entre 5 e 7.
d) valores entre 5 e 3.
e) sempre o valor 7.
06) Um líquido, num frasco aberto, entra em ebulição a partir do momento em que a sua pressão de vapor
se iguala à pressão atmosférica. Assinale a opção correta, considerando a tabela, o gráfico e os dados
apresentados, sobre as seguintes cidades:
A temperatura de ebulição será:
a) maior em Campos do Jordão.
b) menor em Natal.
c) menor no Pico da Neblina.
d) igual em Campos do Jordão e Natal.
e) não dependerá da altitude.
ENEM – 1999
07) A gasolina é vendida por litro, mas em sua utilização como combustível, a massa é o que importa. Um
aumento da temperatura do ambiente leva a um aumento no volume da gasolina. Para diminuir os
efeitos práticos dessa variação, os tanques dos postos de gasolina são subterrâneos. Se os tanques
não fossem subterrâneos:
I. Você levaria vantagem ao abastecer o carro na hora mais quente do dia pois estaria comprando
mais massa por litro de combustível.
II. Abastecendo com a temperatura mais baixa, você estaria comprando mais massa de combustível
para cada litro.
III. Se a gasolina fosse vendida por kg em vez de por litro, o problema comercial decorrente da
dilatação da gasolina estaria resolvido.
Destas considerações, somente:
a) I é correta.
b) II é correta.
c) III é correta.
d) I e II são corretas.
e) II e III são corretas.
08) Suponha que um agricultor esteja interessado em fazer uma plantação de girassóis. Procurando
informação, leu a seguinte reportagem:
Solo ácido não favorece plantio
Alguns cuidados devem ser tomados por quem decide iniciar o cultivo do girassol. A oleaginosa deve
ser plantada em solos descompactados, com pH acima de 5,2 (que indica menor acidez da terra).
Conforme as recomendações da Embrapa, o agricultor deve colocar, por hectare, 40 kg a 60 kg de
nitrogênio, 40 kg a 80 kg de potássio e 40 kg a 80 kg de fósforo.
O pH do solo, na região do agricultor, é de 4,8. Dessa forma, o agricultor deverá fazer a “calagem”.
(Folha de S. Paulo, 25/09/1996)
Suponha que o agricultor vá fazer calagem (aumento do pH do solo por adição de cal virgem – CaO).
De maneira simplificada, a diminuição da acidez se dá pela interação da cal (CaO) com a água presente
no solo, gerando hidróxido de cálcio (Ca(OH)2), que reage com os íons H
+
(dos ácidos), ocorrendo,
então, a formação de água e deixando íons Ca
2+
no solo.
Considere as seguintes equações:
I. CaO + 2 H2O → Ca(OH)3
II. CaO + H2O → Ca(OH)2
III. Ca(OH)2 + 2 H+ → Ca2+ + 2 H2O
IV. Ca(OH)2 + H+ → CaO + H2O
O processo de calagem descrito acima pode ser representado pelas equações:
a) I e II.
b) I e IV.
c) II e III.
d) II e IV.
e) III e IV.
As informações abaixo foram extraídas do rótulo da água mineral de determinada fonte.
Indicadores ácido base são substâncias que em solução aquosa apresentam cores diferentes conforme o
pH da solução.
O quadro abaixo fornece as cores que alguns indicadores apresentam à temperatura de 25°C
09) Suponha que uma pessoa inescrupulosa guardou garrafas vazias dessa água mineral, enchendo-as
com água de torneira (pH entre 6,5 e 7,5) para serem vendidas como água mineral. Tal fraude pode ser
facilmente comprovada pingando-se na “água mineral fraudada”, à temperatura de 25°C, gotas de:
a) azul de bromotimol ou fenolftaleína.
b) alaranjado de metila ou fenolftaleína.
c) alaranjado de metila ou azul de bromotimol.
d) vermelho de metila ou azul de bromotimol.
e) vermelho de metila ou alaranjado de metila
10) As seguintes explicações foram dadas para a presença do elemento vanádio na água mineral em
questão
I. No seu percurso até chegar à fonte, a água passa por rochas contendo minerais de vanádio,
dissolvendo-os.
II. Na perfuração dos poços que levam aos depósitos subterrâneos da água, utilizaram-se brocas
constituídas de ligas cromo-vanádio.
III. Foram adicionados compostos de vanádio à água mineral.
Considerando todas as informações do rótulo, pode-se concluir que apenas:
a) a explicação I é plausível.
b) a explicação II é plausível.
c) a explicação III é plausível.
d) as explicações I e II são plausíveis.
e) as explicações II e III são plausíveis.
11) A água do mar pode ser fonte de materiais utilizados pelo ser humano, como os exemplificados no
esquema abaixo.
Os materiais I, II, III e IV existem como principal constituinte ativo de produtos de uso rotineiro. A
alternativa que associa corretamente água sanitária, fermento em pó e solução fisiológica com os
materiais obtidos da água do mar é:
12) A construção de grandes projetos hidroelétricos também deve ser analisada do ponto de vista do regime
das águas e de seu ciclo na região. Em relação ao ciclo da água, pode-se argumentar que a construção
de grandes represas...
a) não causa impactos na região, uma vez que a quantidade total de água da Terra permanece
constante.
b) não causa impactos na região, uma vez que a água que alimenta a represa prossegue depois rio
abaixo com a mesma vazão e velocidade.
c) aumenta a velocidade dos rios, acelerando o ciclo da água na região.
d) aumenta a evaporação na região da represa, acompanhada também por um aumento local da umidade
relativa do ar.
e) diminui a quantidade de água disponível para a realização do ciclo da água.
A panela de pressão permite que os alimentos sejam cozidos em água muito mais rapidamente do que
em panelas convencionais. Sua tampa possui uma borracha de vedação que não deixa o vapor
escapar, a não ser através de um orifício central sobre o qual assenta um peso que controla a pressão.
Quando em uso, desenvolve-se uma pressão elevada no seu interior. Para a sua operação segura, é
necessário observar a limpeza do orifício central e a existência de uma válvula de segurança,
normalmente situada na tampa.
O esquema da panela de pressão e um diagrama de fase da água são apresentados abaixo.

13) A vantagem do uso de panela de pressão é a rapidez para o cozimento de alimentos e isto se deve à
a) pressão no seu interior, que é igual à pressão externa.
b) temperatura de seu interior, que está acima da temperatura de ebulição da água no local.
c) quantidade de calor adicional que é transferida à panela.
d) quantidade de vapor que está sendo liberada pela válvula.
e) espessura da sua parede, que é maior que a das panelas comuns.
14) Se, por economia, abaixarmos o fogo sob uma panela de pressão logo que se inicia a saída de vapor
pela válvula, de forma simplesmente a manter a fervura, o tempo de cozimento...
a) será maior porque a panela “esfria”.
b) será menor, pois diminui a perda de água.
c) será maior, pois a pressão diminui.
d) será maior, pois a evaporação diminui.
e) não será alterado, pois a temperatura não varia.
15) A tabela a seguir apresenta alguns exemplos de processos, fenômenos ou objetos em que ocorrem
transformações de energia. Nessa tabela, aparecem as direções de transformação de energia. Por
exemplo, o termopar é um dispositivo onde energia térmica se transforma em energia elétrica.
Dentre os processos indicados na tabela, ocorre conservação de energia:
a) em todos os processos.
b) somente nos processos que envolvem transformações de energia sem dissipação de calor.
c) somente nos processos que envolvem transformações de energia mecânica.
d) somente nos processos que não envolvem energia química.
e) somente nos processos que não envolvem nem energia química nem energia térmica.
16) Com o uso intensivo do computador como ferramenta de escritório, previu-se o declínio acentuado do
uso de papel para escrita. No entanto, essa previsão não se confirmou, e o consumo de papel ainda é
muito grande. O papel é produzido a partir de material vegetal e, por conta disso, enormes extensões de
florestas já foram extintas, uma parte sendo substituída por reflorestamentos homogêneos de uma só
espécie (no Brasil, principalmente eucalipto).
Para evitar que novas áreas de florestas nativas, principalmente as tropicais, sejam destruídas para
suprir a produção crescente de papel, foram propostas as seguintes ações:
I. Aumentar a reciclagem de papel, através da coleta seletiva e processamento em usinas.
II. Reduzir as tarifas de importação de papel.
III. Diminuir os impostos para produtos que usem papel reciclado.
Para um meio ambiente global mais saudável, apenas:
a) a proposta I é adequada.
b) a proposta II é adequada.
c) a proposta III é adequada.
d) as propostas I e II são adequadas.
e) as propostas I e III são adequadas.
17) Segundo o poeta Carlos Drummond de Andrade, a "água é um projeto de viver". Nada mais correto, se
levarmos em conta que toda água com que convivemos carrega, além do puro e simples H2O, muitas
outras substâncias nela dissolvidas ou em suspensão. Assim, o ciclo da água, além da própria água,
também promove o transporte e a redistribuição de um grande conjunto de substâncias relacionadas à
dinâmica da vida.
No ciclo da água, a evaporação é um processo muito especial, já que apenas moléculas de H2O
passam para o estado gasoso. Desse ponto de vista, uma das conseqüências da evaporação pode ser:
a) A formação da chuva ácida, em regiões poluídas, a partir de quantidades muito pequenas de
substâncias ácidas evaporadas juntamente com a água.
b) A perda de sais minerais, no solo, que são evaporados juntamente com a água.
c) O aumento, nos campos irrigados, da concentração de sais minerais na água presente no solo.
d) A perda, nas plantas, de substâncias indispensáveis à manutenção da vida vegetal, por meio da
respiração.
e) A diminuição, nos oceanos, da salinidade das camadas de água mais próximas da superfície.
18) Em nosso planeta a quantidade de água está estimada em 1,36 ×10^6
trilhões de toneladas. Desse total, calcula-se que cerca de 95% são de água salgada e dos 5% restantes, quase a metade está retida nos pólos e geleiras.
O uso de água do mar para obtenção de água potável ainda não é realidade em larga escala. Isso
porque, entre outras razões:
a) o custo dos processos tecnológicos de dessalinização é muito alto.
b) não se sabe como separar adequadamente os sais nela dissolvidos.
c) comprometeria muito a vida aquática dos oceanos.
d) a água do mar possui materiais irremovíveis.
e) a água salgada do mar tem temperatura de ebulição alta.
ENEM – 2000
19) No processo de fabricação de pão, os padeiros, após prepararem a massa utilizando fermento biológico, separam uma porção de massa em forma de “bola” e a mergulham num recipiente com água,
aguardando que ela suba, como pode ser observado, respectivamente, em I e II do esquema abaixo.
Quando isso acontece, a massa está pronta para ir ao forno.

Um professor de Química explicaria esse procedimento da seguinte maneira:
“A bola de massa torna-se menos densa que o líquido e sobe. A alteração da densidade deve-se à
fermentação, processo que pode ser resumido pela equação
C6H12O6 2 C2H5OH + 2 CO2 + energia
Glicose álcool comum gás carbônico
Considere as afirmações abaixo.
I A fermentação dos carboidratos da massa de pão ocorre de maneira espontânea e não depende da
existência de qualquer organismo vivo.
II Durante a fermentação, ocorre produção de gás carbônico, que se vai acumulando em cavidades
no interior da massa, o que faz a bola subir.
III A fermentação transforma a glicose em álcool. Como o álcool tem maior densidade do que a água,
a bola de massa sobe.
Dentre as afirmativas, apenas:
a) I está correta.
b) II está correta.
c) I e II estão corretas.
d) II e III estão corretas.
e) III está correta.
20) Ainda hoje, é muito comum as pessoas utilizarem vasilhames de barro (moringas ou potes de cerâmica
não esmaltada) para conservar água a uma temperatura menor do que a do ambiente. Isso ocorre
porque:
a) o barro isola a água do ambiente, mantendo-a sempre a uma temperatura menor que a dele, como
se fosse isopor.
b) o barro tem poder de “gelar” a água pela sua composição química. Na reação, a água perde calor.
c) o barro é poroso, permitindo que a água passe através dele. Parte dessa água evapora, tomando
calor da moringa e do restante da água, que são assim resfriadas.
d) o barro é poroso, permitindo que a água se deposite na parte de fora da moringa. A água de fora
sempre está a uma temperatura maior que a de dentro.
e) a moringa é uma espécie de geladeira natural, liberando substâncias higroscópicas que diminuem
naturalmente a temperatura da água.
21) O gráfico abaixo refere-se às variações das concentrações de poluentes na atmosfera, no decorrer de
um dia útil, em um grande centro urbano.
As seguintes explicações foram dadas para essas variações:
I A concentração de NO diminui, e a de NO2 aumenta em razão da conversão de NO em NO2.
II A concentração de monóxido de carbono no ar está ligada à maior ou à menor intensidade de
tráfego.
III Os veículos emitem óxidos de nitrogênio apenas nos horários de pico de tráfego do período da
manhã.
IV Nos horários de maior insolação, parte do ozônio da estratosfera difunde-se para camadas mais
baixas da atmosfera.
Dessas explicações, são plausíveis somente:
a) I e II.
b) I e III.
c) II e III.
d) II e IV.
e) III e IV.
22) No ciclo da água, usado para produzir eletricidade, a água de lagos e oceanos, irradiada pelo Sol,
evapora-se dando origem a nuvens e se precipita como chuva. É então represada, corre de alto a baixo
e move turbinas de uma usina, acionando geradores. A eletricidade produzida é transmitida através de
cabos e fios e é utilizada em motores e outros aparelhos elétricos. Assim, para que o ciclo seja
aproveitado na geração de energia elétrica, constrói-se uma barragem para represar a água.
Entre os possíveis impactos ambientais causados por essa construção, devem ser destacados:
a) Aumento do nível dos oceanos e chuva ácida.
b) Chuva ácida e efeito estufa.
c) Alagamentos e intensificação do efeito estufa.
d) Alagamentos e desequilíbrio da fauna e da flora.
e) Alteração do curso natural dos rios e poluição atmosférica.
“O ferro pode ser obtido a partir da hematita, minério rico em óxido de ferro, pela reação com carvão e
oxigênio. A tabela a seguir apresenta dados da análise de minério de ferro (hematita) obtido de várias
regiões da Serra de Carajás”.
Fonte: ABREU, S . F. Recursos minerais do Brasil, vol. 2.
São Paulo: Edusp, 1973
23) No processo de produção do ferro, dependendo do minério utilizado, forma-se mais ou menos SO2, um
gás que contribui para o aumento da acidez da chuva. Considerando esse impacto ambiental e a
quantidade de ferro produzida, pode-se afirmar que seria mais conveniente o processamento do minério
da(s) região(ões):
a) 1, apenas.
b) 2, apenas.
c) 3, apenas.
d) 1 e 3, apenas.
e) 2 e 3, apenas.
No processo de produção do ferro, a sílica é removida do minério por reação com calcário (CaCO3).
Sabe-se, teoricamente (cálculo estequiométrico), que são necessários 100 g de calcário para reagir com
60 g de sílica.
Dessa forma, pode-se prever que, para a remoção de toda a sílica presente em 200 toneladas do
minério na região 1, a massa de calcário necessária é, aproximadamente, em toneladas, igual a:
a) 1,9.
b) 3,2.
c) 5,1.
d) 6,4.
e) 8,0.
25) Determinada Estação trata cerca de 30.000 litros de água por segundo. Para evitar riscos de fluorose, a
concentração máxima de fluoretos nessa água não deve exceder a cerca de 1,5 miligrama por litro de
água.
A quantidade máxima dessa espécie química que pode ser utilizada com segurança, no volume de água
tratada em uma hora, nessa Estação, é:
a) 1,5 kg.
b) 4,5 kg.
c) 96 kg.
d) 124 kg.
e) 162 kg.
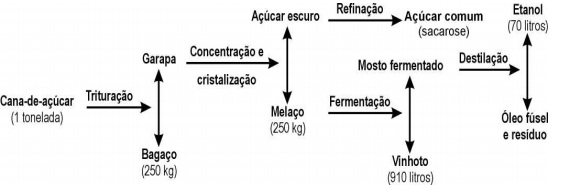
26) O esquema ilustra o processo de obtenção do álcool etílico a partir da cana-de-açúcar.
Em 1996, foram produzidos no Brasil 12 bilhões de litros de álcool. A quantidade de cana-de-açúcar, em
toneladas, que teve de ser colhida para esse fim foi aproximadamente
a) 1,7x10^8.
b) 1,2x10^9.
c) 1,7x10^9.
d) 1,2x10^10.
e) 7,0x10^10.