O Diagrama de Pauling sempre é válido? Conheça o Digrama de Rich-Suter
Um belo padrão
Todo aluno de química utiliza o velho e bom Diagrama de Pauling para realizar a distribuição eletrônica dos elementos. Esse Diagrama, que o próprio Linus Pauling nunca reclamou a autoria, é uma forma simples e rápida de determinar a estrutura eletrônica dos átomos, no entanto, muitos o utilizam mesmo sem saber sua origem ,ou seu significado. Alguns acham que o Diagrama é uma consequência direta do modelo atômico de Bohr, o que é um grande equívoco, uma vez que o belo e fantástico Modelo de Bohr (porém falho) não compreende o conceito de orbitais. E o Diagrama de Pauling nada mais é do que um fila de energia dos orbitais, onde o de mais baixa energia é o orbital 1s, seguindo pelo 2s, 2p, 3s e assim por diante. A construção do diagrama tem uma origem híbrida, baseada tanto na teoria quanto dos resultados experimentais. Seu fundamento pela teoria está em sua própria estrutura, porque o que simplesmente representamos como 1s, 4p, 5d … nada mais são do que funções matemática advindas da mecânica quântica. Os resultados experimentais orientam a ordem energética, pois indica claramente que orbitais do mesmo nível, como 2s e 2p, não possuem a mesma energia (no caso das funções de onda do hidrogênio, onde a mecânica quântica é exata, esses orbitais tem a mesma energia); mostra que o orbital 4s tem energia inferior ao 3d, além de outros casos análogos (conclusão fundamentada por resultados experimentais); omite de orbitais teoricamente existentes, porém sem observação experimental como o 5g, 6h, e outros.
Não restam dúvidas sobre a praticidade, e a aplicabilidade desse diagrama. Sua importância é tamanha que, em qualquer nível de ensino de química, do médio à pós-graduação, seja nas aulas expositivas, seja em livros acadêmicos, ele ainda é utilizado. No entanto, deve ser utilizado com cautela. Por que? Nós utilizamos, e ensinamos, esse diagrama como uma referência a qual todos os elementos devem seguir. Mas será que a natureza, assumindo que o orbitais de fato existem, seria tão obediente e previsível assim? TODOS os mais de 110 elementos que conhecemos, sendo natural ou artificial, iria obedecer esse padrão? É razoável que não … os elementos artificiais, mais pesados, com tempo de vida curto, dificilmente obedeceria alguma regra. Mas … os mais comuns, os elementos do dia-a-dia, devem obedecer. Será mesmo?
Cromo, cobre e seus familiares
Podemos dar uma olhada em dois elementos muito comuns, o cobre e o cromo, que simplesmente não obedecem o Diagrama. Abaixo temos a configuração eletrônica teórica, ou seja, a prevista seguindo o diagrama, e a real, de acordo com os dados experimentais.
Esse é um caso bem conhecido, e a resposta padrão para ele é dizer que:
Como os orbitais d são degenerados, o ideal é que todos tenham o mesmo preenchimento, seja parcialmente preenchido, seja totalmente preenchido, a para isso, existe a transferência interna de um elétron do orbital s para o orbital d.
De fato, se os orbitais d têm a mesma energia, então como podemos ter quatro orbitais parcialmente preenchidos, e um “vazio”, e os cinco serem idênticos do ponto de vista energético? Por isso gerar um “desiquilíbrio energético”, parece que a natureza seguiu uma distribuição mais simétrica no caso do cobre e do cromo. Até que essa explicação funciona bem, porque o mesmo é observado para o molibdênio, que é um “parente” do cromo, e para a prata e o ouro, que são análogos ao cobre. Normalmente vai até ai nossa explicação sobre distribuição eletrônica. Falamos que o Diagrama de Pauling é o modelo perfeito, mas devido a essas “circunstâncias energéticas”, a família do cobre e a família do cromo não o obedecem. Mas nem todos os membros de uma família segue a tradição! Quando olhamos para a configuração eletrônica do tungstênio, que deveria seguir o padrão do cromo e do molibdênio, percebemos que ele segue a distribuição tradicional de Pauling. E ai?
São muitos os rebeldes!
Como explicamos o caso do obediente tungstênio? … Quando olhamos com um pouco mais de atenção observamos que outros elementos não obedecem ao Diagrama, e nem tem sua configuração eletrônica contemplada pela mesma explicação do caso do Cr e do Cu. Vejam os casos abaixo.
Viram? Nióbio, rutênio, ródio, paládio, platina, além de uma grande número de lantanídeos e actinídeos (não mostrados) desobedecem abertamente o Diagrama de Pauling!!! Serão todos esses elementos exceções? Quando explicamos isso em sala de aula chamamos atenção a esses casos? Ou varremos para baixo do tapete, não os mencionamos, e torcemos para que nenhum aluno pergunte sobre eles? Quando perguntam, falamos simplesmente que são exceções?
Não, esses casos não são exceções! Essa é a realidade! O bom Diagrama funciona bem para uma série de elementos, em especial, os representativos, mas falha ao descrever a estrutura eletrônica de vários metais. A natureza nunca foi tão obediente mesmo … mas não é por isso que o Diagrama não tenha o seu mérito. Mas ai? Só isso? O Diagrama de Pauling não funciona para esses elementos e não tem nenhuma explicação para essas observações?
Do Facebook ao Diagrama de de Rich-Suter
Como a maioria dos meus colegas de profissão, eu passava por cima desses casos … até que em uma discussão num grupo de professores de química no Facebook, um colega perguntou como explicávamos esses casos. Vários, incluindo eu, deram suas opiniões sobre isso – nada muito diferente do que está descrito até agora nesse post. Mas outro colega, que eu infelizmente não lembro o nome, sugeriu olharmos para o Diagrama de Rich-Suter.
Até o momento, eu nunca havia ouvido falar nesse diagrama, e decidi procurar na literatura. Para o meu espanto, achei um artigo da Química Nova, escrito por professores da UFRJ (dois deles eu conheço pessoalmente), onde faziam a apresentação desse diagrama como uma “alternativa elegante” para explicarmos os casos onde o Diagrama de Pauling falha, e ao mesmo tempo criticavam como essa ferramenta sequer é citada nos livros mais comuns de Química Inorgânica!
Após ler esse artigo procurei o artigo original do Rich e do Suter, mas não tive acesso. É um artigo do Journal Chemical Education, de 1988, mas infelizmente a Capes não assina esse valioso periódico. Mas pelo artigo da Química Nova deu para entender como funciona esse diagrama, e é isso que eu tentarei explicar agora.
Entendendo o Diagrama de Rich-Suter
Hoje, e já há algum tempo, temos métodos computacionais para resolver, com aproximações, a função de onda de Schrödinger para átomos polieletrônicos. Esses métodos nos fornecem, dentre outras coisas, a energia dos orbitais atômicos. O que o Rich e o Suter fizeram foi aplicar um desses métodos (não sei qual porque não consegui acesso ao artigo original) a cada um dos elementos das séries de transição, e avaliar a energia dos orbitais ns (n-1)d (no caso da primeira série seria 4s3d, da segunda 5s4d, e da terceira 6s5d). Os resultados obtidos nesses casos são mais confiáveis que a série Energética de Pauling, e se tivessem uma versão hoje, seriam ainda mais confiáveis. A principal característica desses diagramas é que a energia dos elétrons de spin α e spin β, com a mesma parte espacial da função de onda, não é a mesma. Isso significa que os dois elétrons do orbital 4s, por exemplo, por terem momento angular de spin diferentes, apresentam energia diferente. Isso pode soar um pouco estranho, mas quem conhece o mundo da Modelagem Molecular sabe que esse é uma forma padrão dos softwares resolverem as Funções de Onda. São os chamados métodos irrestritos, e são bem aceitos pela comunidade acadêmica especializada na área.
Tá, mas… e ai? Como esse diagrama desconhecido resolve o problema do bom e velho Diagrama de Pauling?
Abaixo eu tenho uma figura adaptada do digrama de Rich-Suter para a primeira e a segunda série de transição.
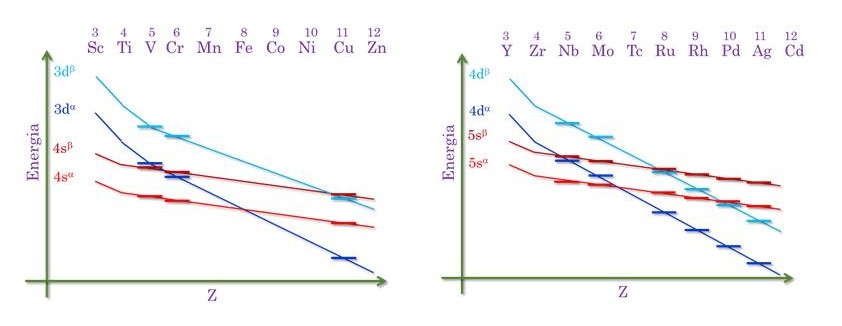
A curvas avermelhadas representam a energia dos orbitais s, enquanto que as curvas azuladas se indicam a energia dos orbitais d. Na verdade, cada curva dessas é um interpolação de pontos, que representam a energia de cada orbital. No eixo x tem-se a carga nuclear. Percebam que em todos os casos a energia dos orbitais diminuem com o aumento da carga nuclear, afinal esses ficam mais próximos do núcleo, e portanto mais estabilizados. Entretanto, a taxa com que os orbitais d se estabilizam é maior do que os orbitais s. Uma forma racional de se entender isso é que, os orbitais d, para qualquer série de transição, estão mais próximos do núcleo do que os orbitais s representados, e portanto eles sofrem maior influência com o aumento da carga nuclear. Na verdade, ai reside o segredo do Diagrama de Rich-Suter. Para cada átomo a energia dos orbitais d e s são diferentes, às vezes seguem a sequência de Pauling, e isso acontece com o primeiros elementos de cada série, às vezes o comportamento é completamente oposto (tudo isso obtido pelos cálculos quânticos computacionais). Na hora de fazermos a distribuição eletrônica, devemos primeiro adicionar os elétrons nos orbitais de mais baixa energia, de acordo com o digrama, para então adicionar nos de mais alta energia (seguindo o princípio de AufBau). Antes de fazermos alguns exemplos, tenho de chamar atenção a um detalhe importante. Um orbital 4sα só pode representar um elétron, porque no 4s temos apenas um elétron com spin α (o mesmo vale para o 4sβ). No entanto, um 3dα representa 5 elétrons degenerados, pois em cada subnível d temos até 5 elétrons com spin α, e os outros 5, se for o caso, serão de spin β. Dito isto, vamos pegar três exemplos, o vanádio, que obedece Pauling, o cobre que não obedece, mas sabemos explicar, e o rutênio que é um dos casos críticos.
Entre os orbitais s e d, o vanádio tem 5 elétrons. O orbital de mais baixa energia é um 4sα, seguido de um 4sβ. Esses dois elétrons representam a configuração 4s2. Sobram 3 elétrons que serão alocados no próximo orbital de mais baixa energia que é o 3dα. Isso leva à configuração 4s23d3, seguindo o diagrama.
No caso do cobre, com 11 elétrons no total, a posição relativa dos orbitais está mudada. A carga nuclear sobre os elétrons é tão forte que provoca esse reordenamento dos orbitais. Então … vamos lá. Ficam 5 elétrons no 3dα, que é o mais estável. O próximo orbital é o 4sα, que fica com um elétrons. Os 5 elétrons restantes vão para o próximo orbital na fila de energia, que é o 3dβ. A configuração do cobre tem portanto, 10 elétrons no orbital 3d e apenas 1 no 4s, como havíamos concluído com a explicação do “desequilíbrio energético”. Mas será que o diagrama é capaz de explicar os demais átomos? Vamos ao rutênio então.
O rutênio tem 8 elétrons, e possui a distribuição dita “anômala”. Pelo diagrama de Pauling sua configuração seria 5s24d6, mas sua configuração real é 5s14d7 (e neste caso, não vale a explicação dada ao cromo e ao cobre). Dos 8 elétrons, 5 já ficam no 4dα, seguido de 1 elétron no 5sα. Os dois elétrons restantes vão para o 4dβ. Pelo diagrama de Rich-Suter a configuração é 5s14d7, idêntica à experimental. Legal, não é?
Vale ressaltar que o diagrama falha em prever a configuração de vários elementos do bloco f. Isso se deve ao método quântico utilizado não ser muito adequado para prever a energia desses orbitais. Mas isso não é de admirar. Hoje, em 2015, ainda não temos um método quântico computacional tão bom assim, imagina em 1988?
Mas ai? Teremos coragem de falar desse Diagrama em nossas aulas, em especial na Graduação? No Ensino Médio também é válido, mesmo sabendo que os alunos não tem base para isso. É melhor eles saberem que tem uma resposta, mas que no momento não saberiam compreendê-la, do que jogar no grande saco das “exceções”. É uma pena que uma ferramenta versátil como essa não esteja nos livros mais comuns. Mas como professores não devemos ficar presos apenas aos livros. Devemos ler artigos, procurar na literatura, ver o que tem sido feito de novo. Queremos essa independência de nossos alunos, logo devemos ser o exemplo para eles!!!
Em: http://universidadedaquimica.com.br/artigos/diagrama-pauling-rich-suter/

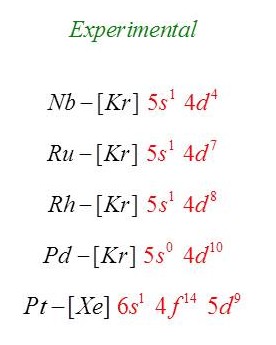







.jpg)